Jeśli miałabym wybrać ulubiony temat, który pojawia się na lekcjach chemii w liceum byłaby to bez wątpienia hybrydyzacja. Co prawda początkowo były między nami słabe relacje, ale stopniowo uczucia się ocieplały, aby w końcu rozpalił się żar prawdziwej miłości.
Hybrydyzacja, czyli co?
Określenie “hybryda” w chemii nie różni się zbytnio od jego potocznego znaczenia. Jest to połączenie cech różnych produktów (tak jak lakier czy samochód hybrydowy), a w chemii mamy na myśli połączenie dwóch lub więcej orbitali różnego typu.
Wiele osób traktuje hybrydyzację jako proces zachodzący gdzieś w mikroskali. Jest to niestety podejście niepoprawne, dlatego, że hybrydyzacja jest wyłącznie zabiegiem matematycznym, który pomaga przewidzieć kształt danej cząsteczki. Przyjmując odpowiedni model hybrydyzacji wiemy, że jej kształt będzie zbliżony do tetraedru, trójkąta czy piramidy trygonalnej.
W liceum obowiązują trzy typy hybrydyzacji: sp, sp2 i sp3. Co oznaczają te zapisy? Mówią o tym ile orbitali danego typu bierze udział w hybrydyzacji. Dla hybrydyzacji sp będzie to jeden orbital typu s i jeden orbital p. Dla sp2 – jeden orbital s i dwa orbitale p. Myślę, że zapisu sp3 nie muszę już tłumaczyć :).
Dlaczego w ogóle stosujemy hybrydyzację?
Zawsze zaczynam wyjaśnianie hybrydyzacji od przykładu cząsteczki metanu. Zastanów się, jak powstaje taka cząsteczka. Do jej zbudowania potrzebujemy atomu węgla i czterech atomów wodoru.

Jak widzisz węgiel ma tylko dwa niesparowane elektrony walencyjne – aby mógł utworzyć cztery wiązania, musimy wprowadzić go w stan wzbudzony.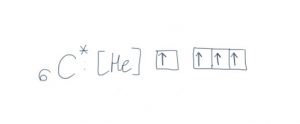
Jeśli opanowałeś już temat stanów kwantowych wiesz, że różne typy orbitali różnią się od siebie energią. Z drugiej strony wiemy, że wiązania w cząsteczce metanu są równocenne. Tutaj wkracza właśnie hybrydyzacja. W rzeczywistości będziemy mieli do czynienia z 4 stanami energetycznymi o energii wyższej niż dla orbitalu s i niższej niż dla orbitalu p.
Jak określić typ hybrydyzacji?
To bardzo proste! Jedyne co musisz policzyć to liczba przyłączonych atomów (wiązań sigma) i liczba wolnych par elektronowych. Ich ilość wskaże ile orbitali bierze udział w hybrydyzacji i będziemy mogli łatwo określić typ hybrydyzacji.
| typ hybrydyzacji | sp | sp2 | sp3 |
| orbitale biorące udział | s, px | s, px, py | s, px, py, pz |
| liczba orbitali | 2 | 3 | 4 |
Weźmy dla przykładu wspomnianą cząsteczkę metanu
Tak jak pisałam wcześniej, musimy policzyć liczbę wszystkich wiązań sigma i wolnych par elektronowych.
Ich suma jest równa 4, a więc cząsteczce węgla odpowiada hybrydyzacja sp3.
Teraz dwie kolejne cząsteczki: amoniaku i dwutlenku węgla.


Cząsteczka amoniaku ma 3 wiązania sigma i jedną wolną parę elektronową na azocie. To odpowiada liczbie 4, a więc hybrydyzacji sp3. Z kolei cząsteczka dwutlenku węgla ma dwa wiązania podwójne, a więc 2 wiązania sigma i dwa wiązania pi. Przypominam, że bierzemy pod uwagę tylko te pierwsze. Zwróć uwagę, że nie liczę wolnych par elektronowych na atomach tlenu, nie wpływają one na kształt cząsteczki. W cząsteczce dwutlenku węgla zaznaczyliśmy 2 punkty, dlatego odpowiada jej hybrydyzacja sp.
Hybrydyzacja, a kształt cząsteczki
Z danym typem hybrydyzacji są powiązane konkretne kształty cząsteczek. Jak się pewnie domyślasz, struktura cząsteczki amoniaku mimo tej samej hybrydyzacji będzie się nieco różniła od cząsteczki metanu. Wszystkie możliwe kształty dla konkretnego typu hybrydyzacji zebrałam w tabeli poniżej. Dokładniej omawiam każdą strukturę w swoim kursie.
| hybrydyzacja | liczba wolnych par elektronowych | kształt cząsteczki (lub fragmentu większej cząsteczki) |
| sp | – | kształt liniowy |
| sp2 | – | kształt trójkątny |
| 1 | kształt kątowy | |
| sp3 | – | kształt tetraedryczny |
| 1 | piramida trygonalna | |
| 2 | kształt kątowy |
Zobacz też:


8 thoughts on “Hybrydyzacja”
Witam serdecznie, mam pytanie, jaki typ hybrydyzacji będzie powiedzmy w c2h4 (etenie), ta cząsteczka ma 5 wiązań sigma i jedno pi ,wiec daje to 5 wiązań sigma i w takim przypadku nie pasuje mi do żadnego typu hybrydyzacji (sp= 2 wiązania sigma, sp2=3 sigma, sp3=4 sigma) wiec w tym przypadku ciężko jest skorzystać z tego sposobu wymienionego powyżej (ilość wiązań sigma=typ hybrydyzacji), może jest jakiś inny jeszcze sposób ? Chyba ze coś jeszcze wpływa na typ hybrydyzacji nie tylko ilość wiązań sigma + wolne pary elektronowe 😁Z góry dziekuje i pozdrawiam 🙂
Hej Krystian! Popełniasz częsty błąd 🙂 Typ hybrydyzacji określa się dla pojedynczego atomu, a nie dla całej cząsteczki. W tym przypadku patrzymy na każdy atom węgla osobno. Każdy z nich tworzy 3 wiązania sigma (dwa z atomami wodoru i jedno z atomem węgla) i jedno pi (którego nie bierzemy pod uwagę). Liczba przestrzenna wynosi 3 – hybrydyzacja sp2, kształt trójkątny. Oznacza to, że atom węgla, który analizujemy, tworzy trójkąt z sąsiadującymi atomami: atom węgla w środku, a dookoła dwa atomy wodoru i jeden atom węgla. Ponieważ cząsteczka jet symetryczna to tak samo będzie w przypadku drugiego atomu węgla 🙂
Natomiast w przypadku atomów wodoru określanie hybrydyzacji nie ma sensu, bo one mogą tworzyć wyłącznie kształt liniowy (tylko jedno wiązanie sigma).
Przyjemny artykuł, pomaga zrozumieć zagadnienie. Nurtuje mnie jednak pytanie – dlaczego wolne pary elektronowe wpływają na hybrydyzację? Rozumiem, że mają wpływ na kształt cząsteczki, tylko interesuje mnie “strona techniczna” tego oddziaływania. Bo elektrony niesparowane – jasne, zmieniają swój poziom energetyczny, aby utworzyć zhybrydyzowany orbital (przynajmniej ja tak to rozumiem). Ale przecież wolne pary nie biorą udziału w tworzeniu wiązania.
Dziękuję za komentarz 🙂 Chodzi tutaj o to, że elektrony (zarówno wolne pary jak i te, które biorą udział w tworzeniu wiązań) oddziałują na siebie elektrostatycznie. Ponieważ są naładowane ujemnie, to wzajemnie się odpychają. Wolne pary elektronowe mają większą “swobodę” niż pary tworzące wiązanie, ponieważ nie są ograniczone przez drugi atom. Dlatego mają wpływ na kształt i to nawet większy niż pary wiążące (np. kąty między wiązaniami w NH3 będą mniejsze niż w CH4)
A jaki typ hybrydyzacji orbitali atomowych węgla jest w cząsteczce np. C2H4 (jest tam 5 wiązań sigma)? Nie mam pomysłu jak to rozwiązać 🙂
Musimy na początek podkreślić jedną rzecz – hybrydyzacja odnosi się do jednego atomu, nie całej cząsteczki. Dlatego bierzemy pod uwagę wiązania, które tworzy dany atom. Patrząc w ten sposób każdy atom węgla ma 3 wiązania sigma, czyli mamy hybrydyzację sp2. Zazwyczaj analizujemy małe cząsteczki, więc sposób, w jaki analizujemy wiązania nie ma znaczenia. W przypadku gdy mamy więcej niż jeden atom centralny musimy patrzeć na każdy z nich osobno 🙂
😉
Pingback: Maturalne pewniaki - Pani od chemii